| Oi meninos nesse sábado iremos construir tirinhas de Química baseado nas tirinhas que vimos do Caruso, para isso iremos utilizar algumas dicas de Evelyn Heine |
Um belo dia a professora chega na classe e pede:
— Queridos alunos, quero que vocês façam uma história em quadrinhos sobre um assunto qualquer! E aí? Para ajudar, criamos este conjunto de dicas. É mais fácil do que muita gente imagina. Você vai até se orgulhar do seu talento!
Primeiro, um exemplo prático. Veja:
1. Primeiro quadrinho:
Desenho - Professora na frente da lousa Balão - Oi, classe! Quero que cada um faça uma história em quadrinhos!
2. Segundo quadrinho:
Desenho - Todos os alunos sentados em suas carteiras com cara de assustados. Balão geral - OH, NÃÃÃO!
3. Terceiro quadrinho:
Desenho - Close de um menino ou menina (você), cara preocupada. Balão - E agora?
Viu só?
Qualquer situação pode virar uma historinha legal. Elas estão aí por toda parte, acontecendo de verdade. A gente consegue usá-las à vontade, mudando, colocando piadinhas, exagerando, misturando fatos.
Para facilitar, primeiro faça um ROTEIRO, assim como o exemplo acima, colocando no papel como será a história toda.
Depois, faça as contas!
Isso mesmo. Veja quantos quadrinhos sua história inteira vai ter. Aí tente descobrir de quantas páginas ela precisa.
Exemplo: 12 quadrinhos. Aí eu posso colocar em 2 páginas, 6 quadrinhos em cada uma. Dividindo uma folha de sulfite ao meio, posso fazer uma CAPA na primeira página, deixar a história na segunda e terceira, colocar meu nome e série na quarta, a última. 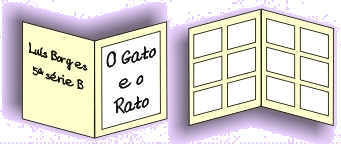
Mas isto é só um exemplo. Algumas professoras já dizem se querem uma página ou apenas uma TIRINHA (história bem curta que é só uma tira mesmo, como as dos jornais).
A “cara” da história
Quando você pensa na disposição e no formato dos quadrinhos, calculando as páginas, está fazendo uma coisa que se chamaDIAGRAMAÇÃO.
“Diagramar” é decidir a forma e o tamanho dos quadrinhos, lembrando que um pode ser o dobro dos outros e ocupar uma tira inteira, por exemplo. 
Outro pode ser pequeno, somente com um “som” do tipo “TUM”, “CRÁS”, “NHACT”...
Ai! Não sei desenhar!
Se você acha difícil desenhar ou inventar personagens, não se preocupe. Qualquer coisa que existe pode virar um personagem de quadrinhos. Mesmo bem simples. Basta um par de olhos, duas pernas ou qualquer característica dos seres humanos para “animar” algo que não tem vida.
 Quer um bom exemplo? Uma esponja-do-mar virou um dos personagens mais famosos do mundo, não é mesmo? O criador do Bob Esponja foi muito criativo! Quer um bom exemplo? Uma esponja-do-mar virou um dos personagens mais famosos do mundo, não é mesmo? O criador do Bob Esponja foi muito criativo!Então, comece a observar alguns personagens por aí. Nas propagandas, logotipos de empresas, mascotes de times de futebol...  Outra coisa: não precisa ser um desenho. Você pode fazer uma colagem para criar seu personagem. Um triângulo é o corpo, uma bola é a cabeça. Quem sabe até uma bola de futebol ou de basquete... se for um cara fanático por esportes... Outra coisa: não precisa ser um desenho. Você pode fazer uma colagem para criar seu personagem. Um triângulo é o corpo, uma bola é a cabeça. Quem sabe até uma bola de futebol ou de basquete... se for um cara fanático por esportes...Quando você começar, vai perceber que sua imaginação achará boas idéias.
Outra dica você pode usar o programa HAGÁQUE ou usar os sites abaixo:
Mão na massa!
Dica importante: para fazer cada quadrinho, comece pelo texto (balões dos personagens).
Depois faça os desenhos. Sabe por quê? Porque, geralmente, a gente se empolga com o cenário, os personagens, e depois não cabem mais os balões. Fica tudo encolhido e ninguém consegue ler direito.
Outra sugestão:
Se quiser, faça os quadrinhos em papéis já recortados e depois cole-os numa folha preta, deixando espaços iguais entre eles. Em vez de preta, escolha a cor que preferir, sempre contrastando com a dos quadrinhos para ficar legal. 
As letras
 Use apenas letrasMAIÚSCULAS. Use apenas letrasMAIÚSCULAS.Capriche bem nas letras para ficarem mais ou menos do mesmo tamanho. Você pode destacar palavras importantes ou gritos com cores mais fortes, assim como usamos o NEGRITO (N) no computador. Escreva as letras antes de fazer o balão em torno delas.
Tipos de balões

Onomatopéias
Hein? Isso mesmo: “onomatopéias” são palavras que imitam sons.
Veja algumas delas.
FORA DOS BALÕES:

OU DENTRO DOS BALÕES:

Final da história
O final é muito importante. É o desfecho do seu trabalho. Imagine que todo leitor gosta de uma surpresa no final.
Coloque a palavra “fim” no último quadrinho. 
O título
Quando souber como será sua história, invente um título para ela. Lembre-se de deixar espaço no início da primeira página.
Não complique!
Cena complicada demais pra desenhar?
Pense em outra. Sempre há uma solução mais simples... Frase comprida demais? Tente cortar o que não faz falta. Finja que está dizendo a mesma coisa, mas com pressa. Este é um bom truque. 
Faça a lápis primeiro.
Assim dá pra mudar algo errado, diminuir o textos, estas coisas.
Dica de Português
Sempre coloque vírgula entre o VOCATIVO e o resto da frase.
Exemplos: Oi, turma! Mãe, você deixa eu brincar? Gente, vamos jogar bola! Pára com isso, menina! Vocativo é a pessoa ou pessoas com quem o personagem fala. (Invoca). |